周青宏,覃宗帅,郑频,王语阳,岑兰英,苏拾香,黄秀权,覃月秋
(1. 右江民族医学院附属医院消化内科,广西 百色 533000;
2. 右江民族医学院研究生学院,广西 百色 533000)
急性胰腺炎(acute pancreatitis,AP)具有急性起病和疾病过程多变的临床特点,多数AP患者病情较轻,仅有胰腺实质的局灶性炎症,病程自限,恢复快,预后好;
20%的AP患者进展为重症急性胰腺炎(SAP)[1]。在炎症过程中,由坏死或非致死性损伤细胞释放到细胞质中的血清高迁移率族蛋白B1(high mobility group protein B1,HMGB1)充当促炎细胞因子不断浸润细胞,导致炎性细胞释放各种介质,如一氧化氮(nitric oxide,NO)。大量AP的临床试验和动物模型结果表明[2-3],包括HMGB1、NO在内的局部和全身炎症介质之间存在复杂的相互作用。HMGB1是一种在真核生物中普遍存在的、多功能的、与DNA结合的非组蛋白,广泛分布于多种哺乳动物细胞。在大多数细胞中,HMGB1位于细胞核,其参与调控转录、复制、DNA修复和核小体形成等过程,这些过程对于维持体内稳态细胞功能具有重要作用[4]。
HMGB1一旦由细胞核进入细胞质,就会产生多种炎症反应,并可以主动释放到细胞外空间和循环中。HMGB1已经被证实在AP中高表达,与胰腺腺泡细胞损伤及病情发展密切相关[5]。NO是一种气态的神经递质,是具有高度活性的自由基,由L-精氨酸在一氧化氮合酶(nitic oxide synthase,NOS)同工酶催化作用下产生[6]。NO是血管扩张剂和旁分泌调节剂,它具有复杂的生物作用,可作为抗炎介质参与炎症过程,浓度过高时可产生细胞毒作用,对机体造成损害。在胰腺中,NO可调节胰腺外分泌、内分泌胰岛素的分泌和胰腺微血管血流[7]。AP中的NO明显升高,其促进炎症因子的产生,加重炎症反应,并增加了疼痛因子的表达。研究发现,HMGB1促使胰腺腺泡细胞NO生成增多,而NO致腺泡细胞损伤,HMGB1和NO的关系有待进一步阐明[2]。本文采用ELISA、分光光度法检测HMGB1及NO水平,探讨HMGB1、NO对评估AP严重程度、患病的敏感性和特异性,分析不同严重程度AP中HMGB1与NO表达的相关性。
1.1 一般资料 收集2021年9月至2022年9月于右江民族医学院附属医院治疗的70例AP患者资料,其中轻症急性胰腺炎(mild acute pancreatitis,MAP)组27例,中度重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)组21例,重症急性胰腺炎(severe acute pancreatitis,SAP)组22例,同时选取本院同期健康体检者32例作为对照组,4组的一般资料比较,差异无统计学意义(P>0.05),见表1。AP诊断及分级标准符合《中国急性胰腺炎诊治指南(2021)》[8]。入选病例均排除心脑血管疾病、肝肾疾病、自身免疫性疾病、血液系统疾病及肿瘤等。本研究经医院医学伦理委员会批准,受试者签署知情同意书。

表1 4组一般资料比较结果
1.2 方法
1.2.1 收集样本 收集患者的一般资料(年龄、性别)。采集入院24 h内空腹静脉血3~5 mL,室温静置2 h,3000 r/min,离心15 min,抽取血清放入Eppendor管中,置于-80 ℃冰箱冷冻保存待检,做好预处理后分别测定血清中的HMGB1及NO水平。
1.2.2 HMGB1检测 按照Human HMGB-1 ELI-SA Kit(Elabscience Biotechnology,中国,武汉)试剂盒说明书做好前期工作准备并按步骤操作,用酶标仪测定在450 nm波长处血清的OD值,HMGB1浓度与OD450值之间呈正比,通过绘制标准曲线计算出血清中HMGB1的浓度,见表2。
1.2.3 NO的检测 按照NO检测试剂盒(Beyotime Biotechnology,中国,上海)说明书步骤操作,用分光光度法测定血清在560 nm的吸光度,通过绘制标准曲线计算出样品中NO的浓度,见表2。

表2 4组患者HMGB1、NO对比结果
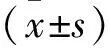
2.1 各组HMGB1、NO水平比较结果 MAP组、MSAP组、SAP组患者血清中HMGB1、NO水平均高于对照组(P<0.01);
MSAP组的NO水平高于MAP组(P<0.001),而HMGB1水平差异无统计学意义(P>0.05);
SAP组的HMGB1、NO水平高于MAP及MSAP组(P<0.05),见图1。

注:A代表各组HMGB1水平差异;
B代表各组NO水平差异。*P<0.05;
**P<0.01;
***P<0.001;
△P为差异无统计学意义。图1 各组之间HMGB1、NO水平差异比较结果
2.2 HMGB1和NO评估AP严重程度及患病的ROC曲线 根据ROC曲线显示,HMGB1和NO对评估AP患病相较于评估AP严重程度的曲线下面积、敏感性和特异性更佳,见表3、表4、图2A、图2B。

表3 HMGB1和NO评估AP患病的ROC曲线数据分析结果

表4 HMGB1和NO评估AP严重程度的ROC曲线数据分析结果

注:A代表HMGB1和NO评估AP患病的ROC曲线;
B代表HMGB1和NO对评估AP严重程度的ROC曲线。图2 HMGB1、NO水平在不同程度AP中的ROC曲线分析结果
2.3 不同组别的HMGB1和NO的相关性分析结果 Spearman相关性分析显示,在MAP组、MSAP组中,血清 HMGB1 水平与NO水平无相关性(P>0.05),见表5及图3A、图3B;
在SAP组中血清 HMGB1水平与NO水平具有相关性(r=0.672,P<0.001),且呈正相关,见表5及图3C。

表5 不同组别的HMGB1和NO表达的相关性分析数据

图3 MAP组、MSAP组、SAP组中血清HMGB1与NO的相关性分析结果
HMGB1是一种染色体蛋白质,组织分布广泛,但多数位于细胞核。HMGB1的生理功能与其复杂的结构有关,它本身有助于DNA的合成以及染色质结构的稳定,作为炎症因子或损伤分子模式时,可以参与多条信号传导,促进细胞凋亡或炎性损伤[5]。NO是一种气态分子,其生成受到一氧化氮合酶(NOS)的催化以及精准电子链的传输控制,不同浓度的NO可以在人体产生不同的生理作用,NO水平升高往往提示炎症的进展。目前,关于AP中HMGB1与NO的关系尚未有明确的定论。HMGB1通过参与多种信号通路,诱导炎症因子的产生,导致胰腺损伤,而NO是AP局部和全身炎症的潜在关键介质,特定NOS抑制剂的实验研究支持NO是在NOS介导下产生并发挥作用[9-10]。HMGB1可以与下游受体结合,触发NF-κB核移位并活化[1],诱导巨噬细胞中iNOS表达增加,诱导型一氧化氮合酶(iNOS)活性增加,促使大量NO产生,当NO浓度达到一定程度时,会对胰腺产生不可估量的损害,使得AP患者病情迅速恶化[11]。尽管HMGB1和NO已经被证实在AP中高表达,但其临床意义及HMGB1和NO相互作用与AP炎症损伤之间的关系少见报道。
为了探讨在AP中HMGB1与NO之间是否存在相互关系,本研究收集了不同严重程度的AP患者的血清,采用ELISA、分光光度法检测血清中的HMGB1及NO水平,探讨在不同严重程度的AP中HMGB1和NO表达水平的差异对AP患病及评估AP严重程度的敏感性和特异性,分析HMGB1与NO表达的相关性,阐述它们之间可能存在的相互关系。各组HMGB1和NO表达水平结果显示,MAP组、MSAP组、SAP组患者血清中HMGB1、NO水平均显著高于对照组,AP严重程度越高,HMGB1及NO的水平越高,两者表现出相同的趋势,与前人研究的结果一致[3,9]。
本课题组进一步进行ROC曲线分析,结果提示HMGB1及NO对AP患病及病情严重程度的评估有一定的价值。对于AP患病的评估,HMGB1的AUC为0.825,P<0.001,其敏感性及特异性分别为78.60%、87.50%,NO的AUC为0.931,P<0.001,其敏感性及特异性分别为81.40%、93.90%;
对于AP严重程度评估,HMGB1的AUC为0.705,P<0.01,其敏感性及特异性分别为44.20%、96.30%,NO的AUC为0.867,P<0.001,其敏感性及特异性分别为95.30%、66.70%,显然NO评估AP患病的敏感性及特异性更高,HMGB1在评估病情严重程度中敏感性较NO低,但特异性却比NO高,总体来说,HMGB1和NO对评估是否患病的敏感性及特异性结果更为理想。造成这些结果的原因可能是,HMGB1作为一种具有高电泳迁移率的非组蛋白核蛋白,其生理功能和特性与它复杂的结构有关,它是由两个串联的折叠螺旋DNA以及包含一串谷氨酸和天冬氨酸的酸性尾巴组成,具有较高的流动性,当HMGB1释放到细胞外环境中时,可以引起全身炎症反应[2]。NO是可以在全身广泛分布的气体信号分子,在AP中充当气体递质,与HMGB1相比,它具有以下特点:①分子量小,分子结构简单,生物功能发挥快;
②它们是内源性合成、储存和分散在体内的;
③它们可以在不使用任何运输载体的情况下穿梭细胞膜[6],基于这些特性,在炎症反应中,NO可能比HMGB1具有更强的流动性,分布更为广泛,因此NO在本研究的ROC曲线结果中敏感性更高,而HMGB1的结构特性则在某些方面赋予了更高的特异性。
为了解HMGB1表达与NO表达的相互关系,本课题组进行了相关性分析。结果发现,在SAP组中,血清 HMGB1及NO水平较对照组、MAP组明显升高,在SAP组中呈正相关,且相关性较强,而在MAP组、MSAP组中无明显相关性,说明在AP中,严重程度越高,HMGB1对促进NO的产生起到一定的作用,但具体机制仍待探究。HMGB1能与多种受体相结合,介导细胞炎症、免疫、增殖、迁移、自噬、凋亡,可能使NF-κB/MAPK活化,诱导NOS表达增加,提高NOS活性,间接促进炎性因子NO的产生[6,12]。这就导致SAP时,NO的浓度明显升高,其损伤作用在机体中表现为直接作用和间接作用。直接作用即引起难治性血管扩张,造成有效循环血容量减少,从而减少胰腺或者其他脏器血流造成缺血缺氧损伤,间接作用表现为大量NO与周围的氧自由基等物质反应而生成活性氮氧化物(reactive nitrogen oxide species,RNOS),再由RNOS发挥NO的间接作用[13-15]。然而,在生理情况下,一定水平的NO浓度可以起到扩张微血管、抑制血小板聚集和白细胞黏附、神经元活动的重要介质的生物功能,介导一系列免疫病理过程[3,7,11],这可能是本研究中MAP组、MSAP组的HMGB1与NO水平无明显相关性的原因。
综上所述,血清HMGB1及NO的表达水平有助于判断AP患者的严重程度,HMGB1可能通过正向调控NO表达参与SAP的发生发展。探讨HMGB1和NO的表达水平及相互关系,可为人们认识HMGB1及NO在AP发生发展中所扮演的角色提供一个全新的视角,也可能为AP的诊断和防治提供一个新的靶点。
猜你喜欢敏感性患病胰腺《中华胰腺病杂志》稿约中华胰腺病杂志(2021年1期)2021-02-26野生动物与人兽共患病科学(2020年3期)2020-11-26CT,MRI诊断急性胰腺炎胰腺内外病变价值比较云南医药(2020年5期)2020-10-27丹参叶片在快速生长期对短期UV-B辐射的敏感性中成药(2018年11期)2018-11-2418F-FDG PET/CT显像对胰腺良恶性病变的诊断价值中国医学影像学杂志(2018年9期)2018-10-17钇对Mg-Zn-Y-Zr合金热裂敏感性影响中国有色金属学报(2018年2期)2018-03-26受害者敏感性与报复、宽恕的关系:沉思的中介作用中国健康心理学杂志(2015年5期)2015-09-05微小RNA与食管癌放射敏感性的相关研究肿瘤预防与治疗(2014年2期)2014-11-24胰腺损伤24例诊治体会中国民族民间医药·下半月(2011年10期)2011-12-27完形填空训练中学英语之友·上(2010年8期)2010-09-20


