严一杰 魏丽娟 孙建红 张开颜 李雷
(海南省人民医院眼科,海南 海口 570000)
视力障碍是全球性疾病负担,也是致盲的重要原因。随着我国人口老龄化的发展趋势,年龄相关性白内障(Age-related cataract,ARC)的发病率也越来越高,现已成为可逆性视力障碍和失明的首要原因[1-2]。目前,ARC的发病机制尚不完全明确,但已知该疾病发生发展与紫外线辐射、氧化应激、代谢紊乱、药物和其他毒性因素有关[3]。对ARC发展过程中的具体分子机制进行深入研究和阐明,寻找该疾病的病因,开发有效的抗白内障药物,预防、延缓甚至逆转晶状体混浊,最大限度地保护患者的视觉功能[4],这些对于减轻ARC患者压力和社会经济负担具有重要的理论和社会意义。
Rho相关激酶(Rho-associated coiled-coil-forming protein kinase 2,ROCK2)也称为Rho相关卷曲螺旋形成蛋白丝氨酸/苏氨酸激酶,是蛋白激酶A、G和C(PKA/PKG/PKC)家族的成员。ROCK有两个高度同源的异构体,即ROCK1和ROCK2,现已证实ROCK2参与细胞多种生物学过程,例如增殖、凋亡、收缩、粘附和迁移等[4-5],在病理过程中,ROCK2的过度活化会导致血管内皮损伤,内皮细胞的迁移也受到ROCK途径的调控[6]。此外,ROCK2在包括视网膜在内的许多器官中均有表达,而其过度表达会导致多种眼部疾病的发生,如糖尿病视网膜病变和青光眼[7-8]。但关于ROCK2在ARC中的相关作用及机制报道较少。本研究通过检测ARC晶状体前囊膜中ROCK2表达后,利用H2O2诱导人晶状体上皮细胞建立体外ARC模型,观察下调ROCK2表达对人晶状体上皮细胞自噬及氧化损伤的影响,探讨ROCK2在白内障病理过程中可能的作用及其机制,同时为白内障靶向治疗提供新思路。
1.1 研究对象 收集2020年6月~2021年4月在我院进行超声乳化白内障吸出术的ARC患者20例,获取晶状体前囊膜,男11例,女9例,年龄51~72岁,平均(58.91±5.43)岁,并取眼科标本库中无眼科疾病、眼球结构完整且晶状体透明的前囊膜。本研究通过医院伦理委员会审核通过。
1.2 主要材料 人晶状体上皮细胞系HLE-B3(中国科学院上海细胞库);
胎牛血清和DMEM培养基(美国Gibco公司);
H2O2(美国Sigma公司);
免疫组织化学染色试剂盒(北京索莱宝生物公司);
Lipofectamine®RNAiMAX(美国 Invitrogen公司);
Trizol、反转录及荧光定量试剂盒(日本Takara公司);
免疫荧光染色试剂盒(上海翌圣生物公司);
MTT试剂盒、Bradford蛋白测定试剂盒、ECL试剂液和DCFH-DA试剂盒(上海碧云天生物研究所);
超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)及丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);
兔抗人ROCK2单克隆抗体、兔抗人Beclin-1、LC3-II、LC3-Ⅰ、GAPDH多克隆抗体及生物素标记山羊抗兔IgG抗体(英国Abcam公司);
自噬双标腺病毒mRFP-GFP-LC3(美国GeneCopoeia公司);
sh-NC和sh-ROCK2载体均有广州锐博生物公司合成构建,引物序列交由上海生工生物工程公司合成。
1.3 方法
1.3.1 免疫组织化学染色 将ARC及正常晶状体前囊膜清洗后,立即置于10%福尔马林溶液中固定,常规石蜡包埋,组织块连续切片,获得厚度约为4 μm的切片。通过60℃烤箱烤片,浸入枸橼酸缓冲液煮沸10 min,进行热抗原修复,再置于0.3%过氧化氢中室温孵育10 min,以10%山羊血清室温封闭后,采用稀释的兔抗人ROCK2单克隆抗体(1:200)作为第一抗体,与切片在4℃下共孵育过夜。PBS冲洗切片后,滴加稀释的生物素标记山羊抗兔IgG抗体(1∶1000),室温继续共孵育1 h。利用DAB显色,苏木精复染,脱水、透明,中性树胶封片,光学显微镜下观察染色情况,捕获图像,其中黄色至棕色颗粒即为阳性表达,随机选择5个视野,Image J软件分析所选区域的平均密度。
1.3.2 细胞转染与分组 将冻存的HLE-B3细胞取出,置于37℃水浴锅中融化,再以1000 rpm/min离心3 min,弃上清,在沉淀中加入含10%胎牛血清的DMEM低糖培养基,吹打成单细胞悬液,置于37℃、5%CO2条件下培养,2 d更换一次培养基。实验分组与处理具体如下:①对照组:HLE-B3细胞正常培养。②H2O2组:100 μmol·L-1H2O2处理HLE-B3细胞24 h。③sh-NC+H2O2组:转染sh-NC至HLE-B3细胞,以100 μmol·L-1H2O2处理HLE-B3细胞24 h。④sh-ROCK2+H2O2组:转染sh-ROCK2至HLE-B3细胞,以100 μmol·L-1H2O2处理HLE-B3细胞24 h。利用Lipofectamine®RNAiMAX分别将sh-NC和sh-ROCK2序列转染至HLE-B3细胞,严格参照试剂盒说明书操作。
1.3.3 实时荧光定量PCR Trizol试剂提取转染后HLE-B3细胞总RNA,通过反转录操作合成cDNA。以cDNA为模板,根据实时荧光定量PCR试剂盒说明检测扩增,以定量ROCK2 mRNA的表达水平,选择β-actin作为内参基因。反应系统的程序设置为:95℃预变性3 min,1次循环;
95 ℃变性20 s,60 ℃退火15 s,72 ℃延伸45 s,42次循环。实验重复3次,反应结束后,采用2-ΔΔCt法计算ROCK2的mRNA相对表达量。引物序列如下:ROCK2上游5′- ATTCAGCAGCTGGAATCTAA-3′,下游5′-GTCTCTTCTCCAGTTCTAC-3′;
β-actin上游5′-ATCGTCCACCGCAAATGCTTCT-A-3′,下游5′- AGCCATGCCAATCTCATCTTGTT-3′。
1.3.4 Western blot 在转染后或各处理组的HLE-B3细胞中加入预冷RIPA缓冲液,冰上裂解,通过4000 rpm离心15 min以提取总蛋白,Bradford法定量。制备10%SDS-PAGE凝胶,将提取的各组蛋白样品等量上样后,凝胶电泳分离,再电转至PVDF膜,以5%脱脂奶粉室温封闭2 h,TBST洗膜,加入各稀释的一抗抗体,4℃下共孵育过夜。弃去原液,TBST洗膜,加入对应的二抗,室温继续孵育1 h,TBST洗膜。利用ECL显色,凝胶成像系统拍摄各个蛋白条带,以GAPDH作为内参蛋白,Image J软件分析灰度值,计算各目的蛋白的相对表达量。
1.3.5 MTT法 取生长状态良好的HLE-B3细胞,调整密度按1×105个/孔植入96孔板内,置于37℃、5%CO2条件下培养。培养过夜后,按照1.3.2分4组进行对应处理,结束后,继续培养至24、48、72 h,加入50 μL 1×MTT至待测细胞孔,混匀,37℃孵育 4 h,洗掉上清,每孔加入150 μL DMSO,置于摇床振荡10 min,待结晶物完全溶解,酶标仪检测490 nm处各孔的吸光度值(OD值)。
1.3.6 透射电镜观察 收集各处理组HLE-B3细胞,以2000 rpm离心5 min,利用4%多聚甲醛和4%戊二醛混合液固定细胞。将细胞样品包埋并制备成超薄切片,以3%醋酸双氧铀和柠檬酸铅染色。透射电镜下观察细胞内自噬体,并捕获细胞超微结构图像。
1.3.7 细胞免疫荧光染色 将各处理组HLE-B3细胞接种于共聚焦小皿中,置于37℃、5% CO2条件下培养至贴壁,加入mRFP-GFP-LC3病毒液感染细胞,MOI为50,继续孵育2~6 h后,弃掉原培养基,加入新鲜培养基培养。收集细胞,4%多聚甲醛固定10 min,PBS洗涤,封片液封片,共聚焦显微镜观察染色情况,摄取图片,结果中两种荧光融合后出现的黄色斑点代表自噬体,融合后出现的红色斑点代表自噬溶酶体,通过对不同颜色斑点的计数来判断细胞内自噬流水平,每组随机选择3个视野,计数100个细胞中的红点与黄点数目来定量自噬水平。
1.3.8 DCFH-DA法 首先在 DCFH-DA试剂液加入无血清培养液进行稀释(比例为1∶1000),收集各处理组HLE-B3细胞,以2000 rpm离心5 min,弃上清,加入稀释的DCFH-DA重悬细胞,调整密度按2×104个/孔植入24孔板内,37℃下孵育20 min,期间每隔5 min轻晃1次。结束后,以1000 rpm离心10 min,PBS洗涤细胞并将沉淀重悬,通过流式细胞仪进行检测分析ROS。
1.3.9 氧化反应指标测定 采用细胞裂解液裂解各处理组HLE-B3细胞,收集上清液,并进行蛋白电量。按照试剂盒说明书处理样品,酶标仪测定对应波长下各孔A值,检测各组细胞内超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性以及丙二醛(MDA)含量。
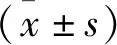
2.1 ROCK2在ARC患者晶状体囊膜中的表达 免疫组化染色检测ARC晶状体囊膜中ROCK2表达,以正常晶状体囊膜作为对照,经检测发现,ARC晶状体囊膜中染色强度较正常组织明显增加,ROCK2表达增强(见图1A)。Western blot检测结果进一步显示,与正常组织比较,ARC晶状体囊膜中ROCK2相对蛋白表达量显著升高(P<0.05),见图1B。

图1 年龄相关性白内障患者晶状体囊膜中ROCK2表达检测Figure 1 Detection of ROCK2 expression in the lens capsule of age-related cataract patients注:A.免疫组织化学染色检测ROCK2表达(400×);
B.Western blot检测ROCK2蛋白表达。与正常组织比较,①P<0.05
2.2 HLE-B3细胞转染效果检测 HLE-B3细胞转染后,通过实时荧光定量PCR和Western blot检测结果显示,与对照组和sh-NC组比较,sh-ROCK2组细胞中ROCK2的mRNA相对表达量和蛋白相对表达量均显著降低(P<0.05),说明转染sh-ROCK2后成功下调HLE-B3细胞中ROCK2表达水平,见图2。

图2 HLE-B3细胞转染效率测定Figure 2 Determination of transfection efficiency of HLE-B3 cells注:与对照组比较,①P<0.05;
与sh-NC组比较,②P<0.05
2.3 下调ROCK2对H2O2刺激下晶状体上皮细胞增殖活性的影响 MTT法检测各处理组HLE-B3细胞增殖活性,结果显示,与对照组比较,H2O2组在转染后24、48、72 h,细胞增殖活性均显著下降(P<0.05);
而相较于H2O2组,细胞转染sh-ROCK2后经H2O2处理时,其增殖活性均显著升高(P<0.05),见图3。

图3 各组HLE-B3细胞增殖活性比较Figure 3 Comparison of the proliferation activity of HLE-B3 cells in each group
2.4 下调ROCK2对H2O2诱导的晶状体上皮细胞自噬的影响 通过透射电镜观察各处理组HLE-B3细胞内自噬情况,对照组细胞内内质网结构紧密,未见自噬体,H2O2组和sh-NC+H2O2组细胞胞质内均可见多个由单层膜或双层膜的自噬体,数目明显多于对照组,sh-ROCK2+H2O2组细胞偶有自噬体,数目较H2O2组明显减少(见图4)。通过免疫荧光染色观察各组HLE-B3细胞内自噬流,与对照组比较,H2O2组细胞内红色斑点和黄色斑点的荧光强度均明显增强,说明H2O2明显激活了自噬溶酶体和自噬体水平(P<0.05);
与H2O2组比较,sh-ROCK2+H2O2组细胞内红色斑点和黄色斑点的荧光强度均明显减弱,细胞内自噬溶酶体和自噬体水平受到抑制(P<0.05)(见图5)。Western blot法检测结果显示,与对照组比较,H2O2组HLE-B3细胞中Beclin-1蛋白相对表达量显著升高,LC3-II/LC3-Ⅰ比值显著上调(P<0.05);
与H2O2组比较,sh-ROCK2+H2O2组细胞中Beclin-1蛋白相对表达量显著降低,LC3-II/LC3-Ⅰ比值显著下调(P<0.05),见图6。

图4 各组HLE-B3细胞内自噬体观察(10000×)Figure 4 Observation of autophagosomes in HLE-B3 cells in each group 注:箭头所指为自噬体

图5 各组HLE-B3细胞内自噬流水平(100×)Figure 5 Intracellular levels of autophagy in HLE-B3 cells in each group 注:红色斑点是自噬溶酶体(mRFP);
黄色斑点是自噬体(mRFP+GFP)

图6 各组HLE-B3细胞中自噬相关蛋白表达Figure 6 Autophagy-related protein expression in HLE-B3 cells in each group注:与对照组比较,①P<0.05;
与H2O2组比较,②P<0.05
2.5 下调ROCK2对H2O2诱导的晶状体上皮细胞氧化应激反应的影响 DCFH-DA法检测各处理组HLE-B3细胞内ROS水平,H2O2组细胞ROS水平较对照组显著上升(P<0.05);
而sh-ROCK2+H2O2组细胞ROS水平较H2O2组则显著下降(P<0.05)(见图7)。H2O2组HLE-B3细胞中SOD和GSH-Px的活性均显著低于对照组(P<0.05),MDA含量显著高于对照组(P<0.05);
而相较于H2O2组,sh-ROCK2+H2O2组细胞中SOD和GSH-Px的活性均显著升高,MDA含量则显著降低(P<0.05),见表1。

图7 各组HLE-B3细胞内ROS水平检测Figure 7 Detection of ROS levels in HLE-B3 cells in each group注:与对照组比较,①P<0.05;
与H2O2组比较,②P<0.05
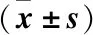
表1 各组HLE-B3细胞SOD和GSH-Px活性及MDA含量比较Table 1 Comparison of SOD and GSH-Px activities and MDA content of HLE-B3 cells in each group
根据世界卫生组织数据显示,由白内障引起的失明约占所有失明人数的50%,而且还在以每年0.4~120万的速度增长,其中ARC的比例最高[2]。迄今为止,手术切除仍是ARC唯一有效的治疗方法,但手术风险、术后并发症及社会经济负担等因素均限制该疗法[9-10]。因此,开发安全且低成本的方案来预防或治疗ARC,是当前眼科疾病临床研究的一项重点内容。
在Rho家族成员中,RhoA不仅在调节细胞骨架、维持细胞形态、平滑肌细胞收缩等细胞活动中起重要作用,而且参与调节多种生物学活动,如平滑肌细胞增殖与细胞粘附。在细胞代谢过程中,Rho蛋白以磷酸鸟嘌呤三核苷酸(GTP)和磷酸鸟嘌呤二核苷酸(GDP)结合形式存在,通过GDP磷酸化和GTP去磷酸化之间的相互转换,诱导或终止细胞级联激活的反应[11-12]。ROCK2作为小GTP酶Rho亚家族的下游效应子,在与Rho中GTP酶相互作用后被激活,并通过一系列途径作用于细胞骨架及其靶蛋白,从而发挥多种生物学效应[4,13]。目前,关于ROCK2在疾病中的研究较为广泛,且多项研究证明抑制ROCK2可在一些疾病中发挥积极作用,如Knipe等[14]研究指出ROCK1和ROCK2均有助于博莱霉素诱导的肺损伤后组织纤维化的发展,而在ROCK1或ROCK2单倍体不足的小鼠中ROCK1或ROCK2的表达降低能够减轻其受博莱霉素诱导的肺纤维化;
Yang等[15]发现ROCK2抑制剂Ripasudil通过调节ROCK2/eNOS信号通路抑制脂多糖诱导的肺微血管内皮细胞凋亡和炎症反应。此外,关于ROCK2在眼科疾病中的研究也已有报道,Gao等[16]研究表明ROCK2抑制剂Ripasudil通过上调miR-136-5p表达可减轻视网膜色素上皮细胞的炎症损伤,经验证还发现miR-136-5p对ROCK1和ROCK2均有靶向作用;
Hida等[17]研究指出抑制ROCK通路能够显著抑制视网膜静脉阻塞的恶化,减少视网膜水肿与非灌注区的大小,并改善了视网膜血流量。本研究结果显示,通过靶向下调HLE-B3中ROCK2的表达后能够抑制H2O2诱导的HLE-B3细胞增殖活性的下降。这一结果同样也提示,抑制ROCK2表达能够减轻H2O2诱导下人晶状体上皮细胞的损伤,推测这可能对于ARC造成的人晶状体上皮细胞损伤起到改善作用。
随着年龄的增长,眼部的不同组织会发生一系列变化,包括线粒体代谢失调、葡萄糖和脂质利用模式改变、甲基化代谢物积累以及牛磺酸代谢受损,这些变化都可能归因于眼病的发生[18]。同时,内源性抗氧化剂如SOD和GSH-Px的活性明显降低,而ROS的产生却增加,ROS的过量产生对包括DNA和蛋白质在内的生物分子造成了结构性损伤,阻碍眼部相关受损细胞核和线粒体DNA的修复过程,从而导致细胞基因组的不稳定、细胞衰老和年龄相关疾病的发生[19-21]。本研究中,在H2O2诱导下HLE-B3细胞发生了氧化损伤,而下调HLE-B3细胞中ROCK2表达能够明显抑制ROS水平,降低MDA含量,并提高SOD和GSH-Px的活性,对H2O2诱导下HLE-B3细胞的氧化损伤起到一定的保护作用。
自噬是一种进化上保守的分解代谢过程,负责依赖溶酶体的降解和再循环,在维持真核生物的细胞内稳态和活力方面发挥着重要作用。在细胞自噬过程中,可以降解异常物质和功能失调的细胞器,以满足和维持细胞的代谢需要,因此,自噬可由多种应激信号诱导,例如饥饿、缺氧、电离辐射、化疗药物以及感染等[22-23]。在一些情况下,自噬可以在细胞中起到机制保护作用,然而,过度自噬引起过度降解,从而对机体造成不利影响,能够引起自噬性细胞死亡。越来越多的研究报道指出自噬与多种眼部疾病有关,如自噬失调会损害小梁网房水流出的通路并促进青光眼的恶化[24],晶状体在氧化应激下过度的自噬反应会导致细胞活力丧失从而进一步促进白内障的发展[25]。现已知,过量的ROS会通过触发线粒体氧化应激,进而导致过度自噬发生[26],本研究检测结果同样显示,经H2O2诱导下HLE-B3细胞ROS水平升高,同时,细胞内自噬体和自噬溶酶体增加,自噬相关蛋白Beclin-1相对表达量显著升高,LC3-II/LC3-Ⅰ比值也显著上调,细胞出现过度自噬现象。通过进一步研究发现,在下调HLE-B3细胞中ROCK2表达后细胞内自噬体和自噬溶酶体均减少,自噬相关蛋白Beclin-1相对表达量显著降低,LC3-II/LC3-Ⅰ比值显著下调,由此说明,下调HLE-B3细胞中ROCK2表达抑制了H2O2诱导下的过度自噬,从而发挥了相关的功能作用。随着医学技术的不断发展,临床上治疗白内障的方法也在增多,并不断提高与完善,生物靶向治疗现也已成为国内外学者在ARC方面研究的热点内容,包括一些抗晶状体上皮细胞增生药物的局部应用,或者通过制备转染抗晶状体上皮细胞抗体和免疫毒素的载体以抑制晶状体上皮细胞的增生等[27]。本研究结果也为ARC的生物靶向治疗研究提供了新的思路。随着生物靶向治疗进一步臻熟和临床应用,相信ARC将得到有效的防治。但ARC的发生涉及多种致病因素,需要从多方位着手以探究有效的综合防治策略。
本研究结果提示,ROCK2在ARC晶状体前囊膜中高表达,下调人晶状体上皮细胞系HLE-B3中ROCK2表达能够明显改善H2O2诱导下细胞内的过度自噬以及氧化损伤,对该细胞达到较好的保护作用。
猜你喜欢晶状体试剂盒诱导齐次核诱导的p进制积分算子及其应用数学物理学报(2021年4期)2021-08-30农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30外伤性晶状体半脱位的CT 表现中国实用医药(2021年7期)2021-04-16同角三角函数关系及诱导公式新世纪智能(数学备考)(2020年10期)2021-01-04试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13玻璃体切除联合晶状体超声粉碎在合并晶状体脱位眼外伤中的应用中医眼耳鼻喉杂志(2019年2期)2019-04-13续断水提液诱导HeLa细胞的凋亡中成药(2017年12期)2018-01-19大型诱导标在隧道夜间照明中的应用中国交通信息化(2017年8期)2017-06-06基于CLSI-M43国际标准改良的Mycoview-AST试剂盒检测性能评估现代检验医学杂志(2016年2期)2016-11-14人工晶状体巩膜缝线固定术矫正儿童玻璃体切割术后无晶状体眼疗效分析中外医疗(2015年5期)2015-08-29


