何 龙,郭好雨,张超凡,杨紫薇,和娜娜,朱奎成
1)郑州大学第一附属医院麻醉与围术期医学部 郑州 450052 2)郑州大学医学科学院实验动物平台 郑州 450052
无毛(hairless,Hr)基因与毛发的生长关系密切。Hr基因缺陷小鼠表现为出生后2周左右被毛逐渐脱落,由此终生保持无毛状态[1-2],无毛小鼠的能量代谢和体温均高于正常小鼠[3],但是原因不明。棕色脂肪组织(brown adipose tissue,BAT)是哺乳动物体内的一种特殊脂肪组织,BAT通过激活解偶联蛋白1(uncoupling protein 1,UCP1)介导线粒体氧化呼吸的电子传递与ATP解偶联,降低氧化代谢的产能效率,使能量以热能形式散发,对维持机体能量代谢和体温恒定具有重要作用[4]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)γ为配体激活核转录因子超家族成员,在BAT中高表达,参与脂肪前体细胞的分化和脂肪氧化过程[5]。PPARγ共激活因子-1α(PPARγ coactivator-1α,PGC1α)是PPARγ重要的协同作用分子,高表达于BAT、心肌、骨骼肌等高能量代谢组织,参与机体能量代谢调节[6]。无毛蛋白为一种核受体转录辅助抑制因子,具有较强的转录抑制功能[7]。无毛蛋白通过抑制PPARγ的表达参与脂肪组织的形成[8]。基于以上论述,我们提出Hr基因缺陷可能通过影响PPARγ-PGC1α-UCP1信号通路,引起BAT产热增加,导致Hr基因缺陷动物的较高能量代谢和较高体温状态,并通过动物实验对该假设进行了验证。
1.1 实验动物雄性Hr基因敲除(Hr-/-)和同窝野生型(Hr+/+)C57BL/6J小鼠各10只,由河南省实验动物中心提供,合格证号:SCXK(豫)2021-0099。饲养环境12 h明/暗交替,温度22~24 ℃,相对湿度40%~70%,动物自由取食、饮水。该实验已获得郑州大学生命科学伦理审查委员会批准。
1.2 小鼠活动量和能量代谢的监测出生后10周内,每周测定小鼠体重1次。第10周,采用TSE PhenoMasterV6.2.0(德国TSE Systems)代谢监测系统记录小鼠活动与全身代谢情况。将小鼠放置于TSE 系统代谢笼中24 h进行环境适应,而后开始记录参数,包括行走活动量与精细活动量,24 h进食量、饮水量、耗氧量和产热量。行走活动量与精细活动量通过代谢笼内的传感器测量,耗氧量、产热量、进食量和饮水量由TSE监控系统自动记录。
1.3 肛温及血清游离三碘甲状腺原氨酸(fT3)浓度测定第10周完成活动量与能量代谢测试后,使用小鼠肛温电子温度计(北京冀诺泰科技公司)测定肛温。七氟烷麻醉下断头处死小鼠,留取血液标本,室温静置2 h,3 000×g4 ℃离心10 min,取上清液-20 ℃保存。采用ELISA法(试剂编号XPEM1036,Xpress-Bio公司)检测fT3浓度。
1.4 BAT组织形态学观察小鼠处死后,取肩胛部BAT,40 g/L多聚甲醛固定24 h,乙醇脱水,二甲苯透化,石蜡包埋,5 μm 厚切片。常规HE染色,显微镜观察,采集图像分析(宁波舜宇RX50)。
1.5 BTA中PPARγ、PGC1α、UCP1蛋白表达的检测取出保存的BAT组织,剪碎放入组织研磨器中,加入预冷RIPA蛋白裂解液(美国Thermo ScientificTM)和蛋白酶抑制剂(德国Roche),冰上研磨后静置10 min,3 000×g4 ℃离心10 min,取下层无油液体层,BCA法测定蛋白浓度。经SDS-PAGE电泳分离,湿转法将蛋白转移至0.45 μm孔径的PVDF膜(美国Merck Millipore),50 g/L脱脂奶粉室温封闭1~2 h;
加入抗PPARγ(1∶2 000,上海Abcam)、抗PGC1α(1∶1 000,美国InvitrogenTM)、抗UCP1(1∶1 000,美国Biovision)、抗GAPDH(1∶3 000,上海Abcam)一抗,4 ℃孵育过夜,TBST洗膜3次,加入HRP标记的二抗(1∶5 000)室温孵育1~2 h,TBST洗膜3次,超敏ECL发光液(美国Invitrogen)中浸泡10~20 s。用全自动化学发光成像系统(中国天能4800)采集图像,用Image-Pro Plus进行灰度分析,以目的蛋白与GAPDH条带灰度值的比值表示目的蛋白表达量。
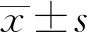
2.1 两组小鼠体重的比较见表1。Hr-/-小鼠和Hr+/+小鼠出生后体重均逐渐增加,但两组之间比较,差异无统计学意义(P>0.05)。
2.2 两组小鼠血清fT3浓度、肛温、进食量、饮水量的比较见表2。饲养第10周,两组小鼠血清fT3浓度差异无统计学意义(P>0.05);
Hr-/-小鼠的肛温、进食量和饮水量均高于Hr+/+小鼠(P<0.05)。

表1 两种小鼠体重的比较 g

表2 两组小鼠血清fT3浓度、肛温、进食量、饮水量的比较
2.3 两组小鼠耗氧量、产热量及活动量的比较见表3。两组小鼠夜间行走活动量和精细活动量均大于白天(P<0.05);
但两组间比较,活动量差异均无统计学意义(P>0.05)。Hr-/-小鼠耗氧量、产热量均高于Hr+/+小鼠(P<0.05)。

表3 两组小鼠耗氧量、产热量、活动量的比较
2.4 两组小鼠BTA形态见图1。BTA主要由多泡脂肪细胞构成,脂肪细胞内散在分布大小不均的脂滴空泡。与Hr+/+小鼠比较,Hr-/-小鼠BAT中多为小空泡,大空泡相对较少。

图1 Hr+/+(上)和Hr-/-(下) 小鼠BTA的HE染色观察结果
2.5 两组小鼠BTA中PPARγ、PGC1α、UCP1蛋白表达的比较见图2和表4。结果显示,PPARγ、PGC1α、UCP1蛋白在两组小鼠的BAT中均有表达,但是Hr-/-小鼠表达水平高于Hr+/+小鼠。

图2 两组小鼠BTA中PPARγ、PGC1α、UCP1蛋白的表达

表4 两组小鼠BTA中 PPARγ、PGC1α、UCP1蛋白表达的比较
无毛蛋白属于Jumonji蛋白家族。啮齿类动物和人类编码无毛蛋白的Hr基因突变可以导致显著的毛发生长障碍,表现为皮肤无毛并出现大量皱褶[9]。既往研究[3]发现,Hr基因突变的啮齿类动物,除了皮肤、毛发异常之外,机体还处于高能量代谢状态。
体温、进食量、饮水量是衡量动物能量获取的重要指标。耗氧量、产热量以及活动量是反映能量代谢的重要指标[10]。本研究结果显示,Hr-/-小鼠的体温、24 h进食量、24 h饮水量高于Hr+/+小鼠,同时耗氧量、产热量均高于Hr+/+小鼠,表明Hr-/-小鼠处于高能量代谢状态,此状态可能对维持无毛条件下的体温恒定具有重要作用。
甲状腺素对机体的正常发育和物质能量代谢具有重要的调节作用,血清fT3是甲状腺素的功能形式[11]。甲状腺素受体属于核受体,是一类受亲脂性配体调控的转录因子,最常见的功能是激活特异靶基因的表达[12]。酵母双杂交实验[13]结果显示无毛蛋白能直接与甲状腺素受体相互作用,在配体不存在时介导后者依赖性的转录抑制。但是本实验中,两组小鼠体重和血清fT3浓度差异无统计学意义,提示Hr基因缺陷并不影响动物甲状腺素的分泌和生长发育。两组小鼠活动量差异亦无统计学意义,提示耗氧量、产热量的增加并不是由活动量增加所致。上述结果说明Hr-/-小鼠的高能量代谢与甲状腺功能无关,可能存在其他机制介导了Hr-/-小鼠的高能量代谢。
哺乳动物的脂肪组织包括白色脂肪组织和BAT,白色脂肪组织具有储能功能,而BAT则介导将储存的能量以热能形式消耗掉。PGC1α主要在BAT、骨骼肌、心脏、肾脏、脑等能量要求高、线粒体丰富的组织中表达,作为辅因子与PPARγ结合,作用于UCP1的启动子,对BAT的产热起到关键作用[14]。本研究中,Hr-/-小鼠BAT中类似白色脂肪组织中的大脂滴减少,同时BAT中PPARγ、PGC1α和UCP1蛋白表达高于Hr+/+小鼠,提示Hr-/-小鼠BAT的产热功能可能增强。
综上所述,Hr基因缺陷可能通过激活PPARγ- PGC1α-UCP1信号通路,增加BAT能量代谢和产热功能,介导了Hr基因缺陷小鼠的高能量代谢和高体温状态。
猜你喜欢肛温无毛耗氧量基因编辑帮助无毛小鼠长出头发军事文摘(2022年8期)2022-05-25系4. 心叶翠雀花系 Ser. Calthifolia广西植物(2020年13期)2020-09-12贵州杜鹃花科植物黔中杜鹃的补充描述四川林业科技(2020年2期)2020-07-09一例成年澳洲种用母羊驼空运途中严重受伤后的救治中国畜禽种业(2019年3期)2019-01-05影响饮用水水质耗氧量检测的因素探讨医药前沿(2018年18期)2018-06-21缩短新生儿直肠温度测量时间的可行性研究护理研究(2017年34期)2017-11-27尤溪河某河段表观耗氧量与营养盐相关性研究*海峡科学(2017年4期)2017-07-12湿热环境下运动对人体肛温、心率和自我感受的影响*实用医药杂志(2015年11期)2015-08-15水中耗氧量的准确测定影响因素分析资源节约与环保(2015年8期)2015-01-27平腕立指手法对热证家兔模型肛温及血液白细胞数的影响云南中医中药杂志(2014年11期)2014-12-31


